Scarica la brochure informativa
INTRODUZIONE
I dispositivi di stimolazione a batteria furono introdotti da C.W. Lillehei e Earl Bakken nel 1958. Nel 1959, l’ingegnere Wilson Greatbatch ed il cardiologo W.M. Chardack svilupparono il primo pacemaker completamente impiantabile, essenzialmente usato per curare pazienti con blocchi atrio-ventricolari completi. Il generatore di questo dispositivo emetteva un impulso di 1 ms con ampiezza di 10 mA ad una frequenza di 60 bpm. La corrente media assorbita dal circuito in queste condizioni consentiva un funzionamento continuo stimato per cinque anni. Questo dispositivo venne chiamato fixed-rate o pacemaker asincrono, perché stimolava il cuore continuamente ad una frequenza fissata. Un fixed rate pacemaker stimola il cuore indipendentemente dalla presenza di una attività̀ ritmica spontanea del cuore, determinando quindi una competizione tra il ritmo del paziente ed il ritmo del pacemaker. Tale competizione tra cuore e pacemaker può̀ indurre aritmie e tra le più̀ gravi la fibrillazione ventricolare, potenzialmente mortale. Aggiungendo un sense amplifier (cosiddetto ‘circuito di sensing’) ad un pacemaker asincrono è possibile rilevare l’attività̀ intrinseca del cuore ed eliminare quindi la competizione, ottenendo un demand pacemaker. Il demand pacemaker fornisce stimolazione elettrica al cuore solo in assenza di un naturale ritmo cardiaco, riducendo inoltre il consumo della batteria. Nel 1970 furono introdotti i dual-chamber pacemaker, ovvero i pacemaker bicamerali in grado di rilevare l’attività̀ cardiaca in atrio e/o in ventricolo al fine di stabilire se necessaria la stimolazione e di stimolare due camere cardiache7. La progressione naturale degli sviluppi del pacemaker ha portato all’invenzione intorno al 1980 da parte di Michael Morchower del defibrillatore cardiovertitore impiantabile (ICD).
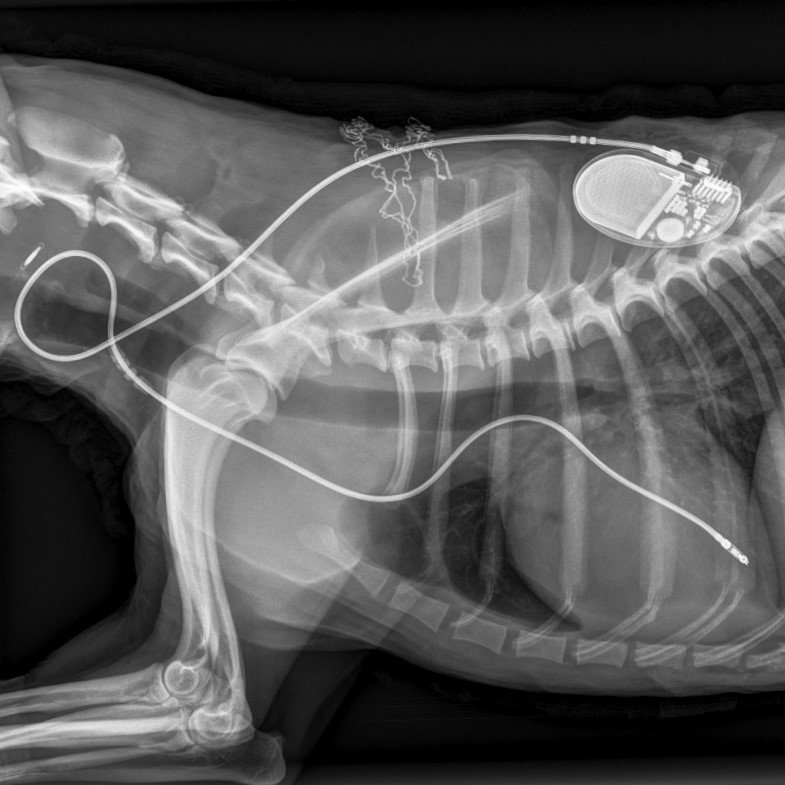
Il pacemaker si compone di un generatore di impulsi, una batteria ed un elettrocatetere. Il generatore di impulsi è il vero e proprio pace-maker, dall’inglese “segna ritmo”, e fornisce il segnale di uscita, che viene inviato alla muscolatura cardiaca. Il pacemaker utilizza l’energia immagazzinata nella batteria per stimolare il cuore. La connessione elettrica tra il cuore ed il generatore di impulsi è fornita dall’elettrocatetere, che ha in punta l’elettrodo fissato al muscolo cardiaco (1). Gli elettrodi del pace-maker possono essere unipolari o bipolari: nel caso unipolare il catodo si trova nel cuore e l’anodo in un’altra parte del corpo; in genere l’anodo è proprio la cassa del pace-maker, realizzata in titanio (materiale biocompatibile). Il circuito elettrico si chiude attraverso il tessuto cardiaco e quello frapposto tra anodo e catodo. Nel caso bipolare, invece, anodo e catodo si trovano sull’estremità dell’elettrocatetere, distanziati di 2-3 cm, e sono posizionati internamente al cuore; il circuito elettrico, dunque, è localizzato completamente nella camera cardiaca da supportare (7).
INDICAZIONI
L’impianto di pacemaker è la procedura d’elezione per il trattamento della bradicardia sintomatica nei cani. Questa tecnica è stata utilizzata per la prima volta nel 1967 in un cane con insufficienza cardiaca congestizia a causa di un blocco atrio-ventricolare di terzo grado ed ora è ampiamente disponibile nei centri di riferimento cardiologici veterinari (2). Le bradiaritmie, per le quali è consigliato questo tipo di trattamento nel cane, sono il blocco atrio-ventricolare di terzo grado, il blocco atrio-ventricolare di secondo grado avanzato, la sindrome del seno malato/disfunzione del nodo sinusale (SSS/SND) e l’arresto atriale persistente, quando non associato ad iperkaliemia (6).
Le conseguenze emodinamiche delle bradiaritmie sono caratterizzate da una diminuzione della portata cardiaca ed un abbassamento della pressione arteriosa. I segni clinici che si evidenziano in corso di bradicardia sono: debolezza transitoria, intolleranza all’esercizio, perdita transitoria dello stato di coscienza e talvolta insufficienza cardiaca congestizia. La varietà ed entità dei sintomi dipende dal tipo di aritmia sottostante, dalla frequenza ventricolare media di scarica e dall’insorgenza di asistolie transitorie.
Studi scientifici riportano che i cani con blocco atrioventricolare di II grado avanzato e di III grado sono a rischio di morte improvvisa nel 42,7% dei casi; di questi pazienti il 24% muore entro 15 giorni dalla diagnosi, mentre il 40% entro i primi sei mesi ed è per questo motivo che dal momento della diagnosi si consiglia di programmare l’intervento con urgenza (5).
La maggior parte dei cani (90%) mostra una risoluzione dei segni clinici dopo l’impianto di pacemaker e le stime di sopravvivenza globale a uno, tre e cinque anni dalla procedura sono rispettivamente dell’86, del 65 e del 39 per cento (2).
PREPARAZIONE PREOPERATORIA
Prima di procedere con l’impianto di pacemaker permanente, è consigliabile eseguire un insieme di esami a fini diagnostici. I pazienti con frequenza ventricolare molto bassa sono l’eccezione a questo, poiché potrebbe non esserci il tempo di valutare completamente un paziente prima di eseguire l’intervento di impianto di pacemaker, che in questo caso verrebbe eseguito in condizioni di urgenza. Un ecocardiogramma per valutare la struttura e la funzione cardiaca, il gruppo sanguigno, il profilo coagulativo, un esame emocromocitometrico, un pannello biochimico completo ed un emogasanalisi, per la valutazione degli elettroliti, sono sempre indicati prima di entrare in sala operatoria. Viene fortemente raccomandata la valutazione del profilo tiroideo e delle patologie trasmesse da ectoparassiti.
È inoltre utile, quando possibile, eseguire una valutazione della concentrazione plasmatica di troponina I, biomarker utile per emettere un sospetto diagnostico di miocardite. Quest’ultima è una causa non comune di bradiaritmie, ma i pazienti affetti da questa malattia possono essere particolarmente aritmogenici quando viene posizionato l’elettrocatetere di stimolazione temporaneo o permanente. Se si sospetta una miocardite (evidenza di infiammazione sistemica dall’emocromo, febbre, ectopie ventricolari, ecc), la troponina I può essere utile nel prendere decisioni terapeutiche preliminari e quindi, se possibile, va posticipata la procedura.
Un’analisi delle urine ed un accurato esame della pelle e dell’orecchio sono allo stesso tempo raccomandati, nel tentativo di evitare di eseguire l’intervento in pazienti che possono essere predisposti ad infezioni. Se sono presenti infezioni del tratto urinario, piodermite od una grave infezione dell’orecchio, nel caso in cui le condizioni cliniche del paziente lo consentano, è preferibile posticipare la procedura per consentire una terapia appropriata ed evitare così il rischio di infezioni del dispositivo (6).
PACING SINGOLO O A DOPPIA CAMERA
La maggior parte dei cani affetti da blocco AV viene trattata mediante impianto di pacemaker a camera singola ventricolare (impianto VVI). Questo tipo di pacemaker è costituito da un elettrocatetere che viene posizionato nel ventricolo destro e pertanto non mantiene la sincronia atrio-ventricolare o la normale sequenza di attivazione ventricolare.
I sistemi di stimolazione a doppia camera, in particolare quelli con due derivazioni, necessitano di più tempo per essere impiantati e richiedono una programmazione leggermente più complessa.
Un altro tipo di stimolazione è quella detta sincrona atriale (tramite l’impianto VDD) che consente la stimolazione a doppia camera con un solo elettrocatetere. Per la stimolazione sincrona atriale, un elettrocatetere viene impiantato nel ventricolo destro, ma a differenza dei sistemi VVI standard, questo elettrocatetere ha un elettrodo fluttuante nell’atrio destro che è in grado di rilevare l’attività elettrica atriale intrinseca e di stimolare la contrazione ventricolare dopo un adeguato ritardo, consentendo quindi la sincronia AV. Sebbene la stimolazione sincrona atriale sia stata riportata in medicina veterinaria, la distanza impostata tra l’elettrodo atriale fluttuante e la punta di stimolazione ventricolare spesso ne impedisce l’uso nei cani di piccola taglia (6).
PROCEDURA
Prima della procedura si realizza la programmazione del generatore d’impulsi in base alle necessità del paziente.
Per la preparazione del paziente viene eseguita una tricotomia estesa della regione del collo e del dorso, in quanto questo è il sito di accesso chirurgico, e della regione toracica, utilizzata per la stimolazione elettrica temporanea qualora necessario.
Tramite l’accesso venoso viene somministrato un antibiotico ad ampio spettro (Cefazolina, 22 mg / kg, EV), ed eparina vister (100 UI/Kg, EV), quest’ultima al fine di prevenire eventi tromboembolici.
Il modo più sicuro per impiantare un pacemaker permanente è utilizzare un metodo di stimolazione temporanea esterna definita come “pacing”, che permette una stimolazione elettrica ed assicura la contrazione miocardica qualora durante la procedura si osservasse una bradicardia troppo marcata2. Il pacing temporaneo esterno viene eseguito utilizzando i sistemi di stimolazione transtoracica disponibili in commercio, consistenti in patchs che vengono applicati sugli emitoraci destro e sinistro in corrispondenza dell’area di proiezione cardiaca. La stimolazione transtoracica è sicura ed efficace, ma non è esente da complicazioni e deve essere eseguita dopo che il paziente è stato sottoposto ad anestesia generale (6).
Una volta indotta l’anestesia tramite l’utilizzo di una infusione di ketamina e diazepam si procede con l’intubazione. Il mantenimento in anestesia generale si esegue tramite una miscela di ossigeno ed isofluorano3. Viene poi eseguito l’isolamento della vena giugulare e si dispongono dei fili di sicurezza attorno ad essa. Successivamente tramite una incisione della vena l’elettrocatetere viene fatto passare attraverso il vaso fino all’apice del ventricolo destro. Una volta posizionato, è importante determinare se il luogo del cavo di stimolazione è adeguato. A questo fine si utilizza un programmatore esterno che permette la valutazione dell’impedenza dell’elettrocatetere.
Viene eseguita una dissezione dei tessuti sottocutanei per creare una tasca dove si inserisce il generatore d’impulsi. I cavi vengono poi collegati alle porte appropriate del generatore di impulsi; cavo e generatore vengono infine inseriti nella tasca sottocutanea e l’incisione viene chiusa more solito. Il collo è avvolto con una benda sterile, che viene lasciata in loco per due settimane e cambiata quando necessario. Tutta la procedura viene eseguita mediante controllo fluoroscopico.
Il primo controllo della ferita chirurgica viene effettuato a distanza di 24 ore dall’intervento e successivamente è raccomandato a distanza di 7 giorni (6).
FOLLOW UP
Nei giorni successivi all’intervento il sito chirurgico di incisione deve essere controllato per eventuali segni di infiammazione od infezione. Questo è in genere fatto con il proprietario del paziente, in modo che questo possa esso stesso vedere come appare il sito chirurgico al momento della dimissione dall’ospedale ed in modo che gli possa essere mostrato, da parte delle figure professionali della struttura medica, come bendare e medicare correttamente il collo.
La prima visita di controllo dal medico veterinario curante è fissata a sette giorni di distanza dalla procedura, salvo la comparsa di complicazioni. Qualora nella zona della ferita chirurgica si noti un rigonfiamento anomalo, è assolutamente controindicato bucare la regione per tentare di aspirare del liquido, perché con tale procedura si rischia di lesionare anche l’elettrocatetere. In tale evenienza si invita a contattare la struttura di riferimento presso la quale è stata effettuata la procedura di impianto di pacemaker.
Nel periodo postoperatorio di 4-6 settimane, il paziente viene sottoposto a restrizione rigorosa di esercizio fisico, infatti il cane deve essere limitato ad effettuare passeggiate al guinzaglio di breve durata e si consiglia di fare in modo che l’animale eviti di saltare e correre, in modo che il pacemaker diventi stabile nella posizione impiantata. È consigliabile l’utilizzo di una pettorina al posto del collare.
Il paziente viene dimesso con copertura antibiotica per due settimane. Dopo un mese dall’impianto del pacemaker viene generalmente eseguito un controllo cardiologico in cui viene eseguito un elettrocardiogramma ed una valutazione del pacemaker e se le condizioni cliniche sono stabili il paziente può anche iniziare a riprendere la normale attività.
Le valutazioni di controllo durante il primo anno vengono eseguite a distanza di uno, tre, sei e dodici mesi dall’intervento; successivamente verranno pianificate su base individuale (6).
COMPLICANZE
Lo sviluppo di un sieroma sul sito della sutura chirurgica, quasi sempre sterile, è un evento abbastanza comune ma che può essere gestito facilmente con un bendaggio del collo leggermente compressivo. È importante sottolineare che se si verifica la formazione di sieroma, il drenaggio del fluido che circonda il generatore non deve essere eseguito, a causa del rischio di introduzione di batteri nel sito e di possibile lesione ai cavi ed al generatore all’interno della tasca cutanea. L’incidenza di un’infezione dopo l’impianto di pacemaker è riportata tra il 5 e il 10%6. In caso di infezione, il trattamento ottimale di un pacemaker infetto è la rimozione dell’intero sistema di elettrocatetere e generatore, terapia antibiotica a lungo termine mirata (tramite coltura e antibiogramma) e sostituzione del sistema di stimolazione.
La trombosi venosa parziale o silente della vena giugulare può avvenire dopo il posizionamento dell’elettrocatetere transvenoso ma in genere non causa segni clinici. Anche l’aderenza/formazione del trombo all’elettrocatetere è talvolta visualizzata al controllo ecocardiografico senza segni clinici associati. Questi tipi di trombi in genere non si delocalizzano e non aumentano di dimensioni nel tempo, tuttavia è consigliabile trattare pazienti con agenti antitrombotici come l’aspirina o clopidogrel se ne viene individuata la presenza.
La perforazione del miocardio causata dall’elettrocatetere è possibile e probabilmente si tratta di un evento non riconosciuto, ma può causare versamento pericardico e pneumotorace.
La complicazione più comune di questo tipo di procedura interventistica, soprattutto nel periodo postoperatorio immediato, è tuttavia sicuramente la dislocazione dell’elettrodo (Twiddler’s Syndrome), che nei casi più gravi dovrà essere riposizionato o sostituito (2, 4, 6).
BIBLIOGRAFIA
Rapsang AG and Bhattacharyya P. Pacemakers and implantable cardioverter defibrillators–general and anesthetic considerations. Braz J Anesthesiol. 2014;64:205-14.
Johnson MS, Martin MW and Henley W. Results of pacemaker implantation in 104 dogs. The Journal of small animal practice. 2007;48:4-11.
Sanchis-Mora S, Viscasillas J, Mathis A, Palacios C, Brodbelt DC and Alibhai HI. Anaesthetic management and complications of pacemaker implantation in dogs. Vet Rec. 2014;175:30
Swanson LE, Huibregtse BA and Scansen BA. A retrospective review of 146 active and passive fixation bradycardia lead implantations in 74 dogs undergoing pacemaker implantation in a research setting of short term duration. BMC Vet Res. 2018;14:112.
Santilli, Bussadori, Borgarelli Manuale di cardiologia del cane e del gatto, 2012
Weisse C, Berent A, Veterinary image-guided ineterventions, 2015
Novelli E, Magosso E,Dispositivi cardiaci impiantabili: pacemaker e defibrillatori, 2012
